Observe que, se um átomo perder um elétron, seu numero de prótons fica maior que o número de elétrons. Assim, o átomo assume uma carga positiva, transformando-se em um íon positivo, denominado cátion.
Considere novamente o átomo de sódio:
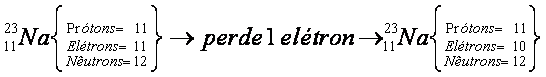
Quando o átomo de sódio perde um elétron, ele se transforma em um íon de carga positiva (+1). Caso o processo seja inverso, ou seja, o átomo receba um elétron, o número de elétrons torna-se superior ao de prótons e o átomo assume uma carga negativa, transformando-se em íon negativo, denominado ânion.
Agora, observe o átomo de cloro:
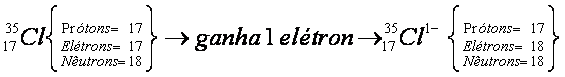
Nesse exemplo, a carga do íon cloro passa a valer -1, pois seu átomo de origem recebeu um elétron.
A quantidade de carga de um cátion ou ânion pode variar de acordo com o número de elétrons que o átomo de origem perdeu ou recebeu. Assim, é possível verificar a existência de íons com carga +1, -1, +2, -2, +3, -3 etc.
Veja um exemplo, considerando o átomo de magnésio:
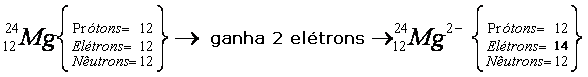
Nenhum comentário:
Postar um comentário